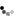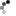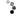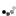学術研究トピックス
【学術研究】腫瘍細胞に結合する人工レクチンの設計に成功しました
横浜市立大学大学院 生命医科学研究科 寺田大樹博士、ジェレミー・テイム教授、生命ナノシステム科学研究科 大関泰裕教授と、理化学研究所 ライフサイエンス技術基盤研究センター 構造バイオインフォマティクス研究チームのケム・ツァン チームリーダー、長崎国際大学大学院 薬学研究科 藤井佑樹講師らの共同研究グループは、抗腫瘍細胞活性を有するムール貝(ムラサキイガイ)のタンパク質MytiLec(マイティレック)-1の構造情報をもとに計算機科学を用いて設計した、人工レクチンMitsuba(ミツバ)-1の作出に成功しました。こうした人工レクチンは、薬剤やタンパク質と複合体化させた新素材として、糖鎖を標的にしたがん治療薬開発への応用が期待されます。
研究成果のポイント
- 抗リンパ腫細胞活性を持つムラサキイガイ由来レクチン「MytiLec-1」のアミノ酸配列を40%改変した人工レクチン「Mitsuba-1」を、コンピューターで設計した。
- Mitsuba-1は、溶液中で安定して存在し、赤血球凝集活性は示さず、リンパ腫細胞の表面にあるグロボトリオース(Gb3)糖鎖に結合した。
研究の背景
動物細胞の表面にあるタンパク質・脂質の多くは、糖鎖が共有結合した糖タンパク質・糖脂質として存在しています。このため、細胞の表面は糖鎖で覆われています。レクチンは動植微生物に広く存在する、糖鎖を識別して結合するタンパク質の総称で、細胞表面の糖鎖と結合して細胞の凝集や増殖の調節を行うことが知られています。
MytiLec-1は、海産無脊椎動物のムール貝(ムラサキイガイ)から発見されたレクチンで、α-ガラクトース糖を末端に持つグロボトリオース(Gb3)糖鎖と結合します(1。Gb3糖鎖を多く持つヒト・バーキットリンパ腫の培養細胞にMytiLec-1を加えると、Gb3と結合し、細胞内部のタンパク質が活性化されて細胞死が起きました(2。MytiLec-1の立体構造は、レクチンの代表的な構造のひとつであるベータ トレフォイル(三つ葉)構造で、抗腫瘍細胞活性の発揮とタンパク質としての安定性の保持には、2量体化を要しました(3。MytiLec-1の抗腫瘍性は、がん治療の創薬に有用と考えられる一方で、赤血球凝集活性を持つため、そのままでは使えません。培養液中の安定性と抗腫瘍性は残しつつ、赤血球凝集活性を除く加工を目的に、計算機科学を用いてMytiLec-1の構造を模して設計した人工レクチン「Mitsuba-1」の開発を行いました。
研究概要と成果
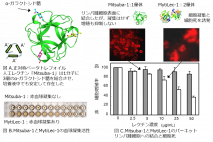
Mitsuba-1を作るために、まず既知の2000以上のべータ トレフォイル構造を計算機で解析し、溶液中での安定性に富む、正対称形の骨格が選ばれました。続いてMytiLec-1のポリペプチド鎖内に3か所ある糖鎖結合サブドメイン(A-B-C)のうち、糖鎖結合性の最も強いAサブドメインを鋳型とし、そのアミノ酸を40%改変したA'-A'-A'型(図A)の人工レクチン「Mitsuba-1」を設計しました。Mitsuba-1タンパク質は、大腸菌に合成させて作り出しました。
Mitsuba-1もMytiLec-1同様、ベータ トレフォイル構造を有しました。その立体構造(PDB ID = 5XG5)は、構造予測のとおりMytiLec-1を模し、3か所ある糖鎖結合部位の全てにGb3糖鎖の末端にあるɑ-ガラクトシド糖が結合することを、X線結晶解析から証明しました(図A)。Mitsuba-1は天然のMytiLec-1の2量体化に必要なアミノ酸配列を欠き、単量体として存在しました。これをバーキットリンパ腫細胞に加えたところ、MytiLec-1のような細胞死は引き起こしませんでしたが、表面のGb3糖鎖を介して細胞に結合しました(図C)。そして、レクチンの創薬上の課題である赤血球細胞の凝集は起こさず(図B)、単量体として設計したMytiLec-1に比べても、培養液中の可溶性など、タンパク質の安定性の点で各段に優れていたことが判明しました。
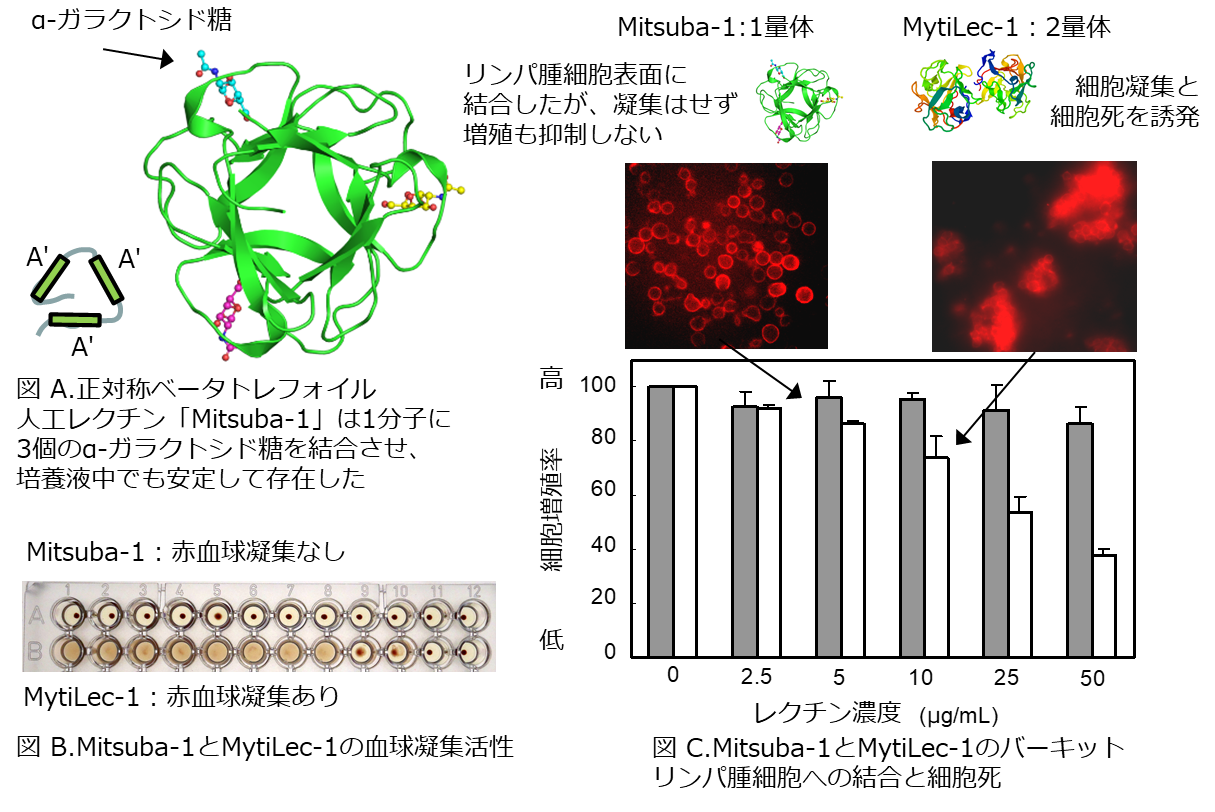
図 Mitsuba-1の立体構造(A)、赤血球凝集活性(B)と、腫瘍細胞への結合(C)
(A) Mitsuba-1は、A'-A'-A'サブドメインを持つポリペプチドからなり、各葉の頂点から中心をみると左右対称で構造的にも安定したベータ トレフォイル形の人工レクチンとして設計された。
(B) MytiLec-1の有した赤血球凝集活性(下段:茶)は、Mitsuba-1では失われ(上段:点)た。
(C) Mitsuba-1はバーキットリンパ腫細胞の凝集、増殖抑制、は共に起こさなかったが、細胞表面への結合は認められた。
今後の展開
本研究の成果として、赤血球の凝集を起こさずに腫瘍表面の糖鎖に結合できる物質ができました。直接に細胞死を起こす性質は失われてしまいましたが、これに抗腫瘍作用のある薬剤やナノ分子、毒素タンパク質と組み合わせて創薬に用いる、という可能性は開かれています。今後も、計算機科学と分子生物学を組み合わせて、がん細胞や幹細胞に出現する糖鎖に結合する人工レクチンのデザインを続けていきたいと思います。大腸菌を用いて構造上安定したレクチンを作出する技術は確立しつつあり、ナノ分子や薬剤を人工レクチンと複合体化した新素材タンパクを作れる条件を追求し、糖鎖とレクチンを医科学研究と医療の発展に役立てたいと考えています。
参考文献
- Fujii Y, Dohmae N, Ozeki Y et al. J Biol Chem 287, 44772-44783 (2012)
- Hasan I, Terada D, Fujii Y, Ozeki Y et al. Marine Drugs 13, 7377-7389 (2015)
- Terada D, Fujii Y, Ozeki Y, Tame J et al. Sci. Rep. 6, 28344 (2016)
研究費情報
本研究は、科学研究費補助金、理化学研究所国際特別研究員研究費、横浜市立大学基礎研究費、長崎国際大学教員研究費、を受けて行われました。
論文情報
Computational design of a symmetrical β-trefoil lectin with cancer cell binding activity
Daiki Terada, Arnout R. D. Voet, Hiroki Noguchi, Kenichi Kamata, Mio Ohki, Christine Addy, Yuki Fujii, Daiki Yamamoto, Yasuhiro Ozeki, Jeremy R.H. Tame, Kam Y. J. Zhang.
https://www.nature.com/articles/s41598-017-06332-7
Scientific Reports 7, 5943 (2017) doi:10.1038/s41598-017-06332-7 。
日本経済新聞